Neue Mikroskopie-Methode liefert unerwartete Einblicke in das Innenleben von Zellen
Durch die Kombination dreier bildgebender Verfahren ist es Wissenschaftler*innen des Max-Planck-Instituts für die Physik des Lichts in Erlangen und des Center for Molecular and Cellular Bioengineering der Technischen Universität Dresden jetzt gelungen, mechanische Eigenschaften des Zellinneren mit bisher unerreichter Präzision zu messen - und dabei überraschende Phänomene zu entdecken. Der neue Mikroskopie-Aufbau kann helfen, Prozesse auf zellulärer Ebene besser zu verstehen, die zum Beispiel zu Alzheimer oder Krebs führen.

Foto: Max-Planck-Institut für die Physik des Lichts (1)
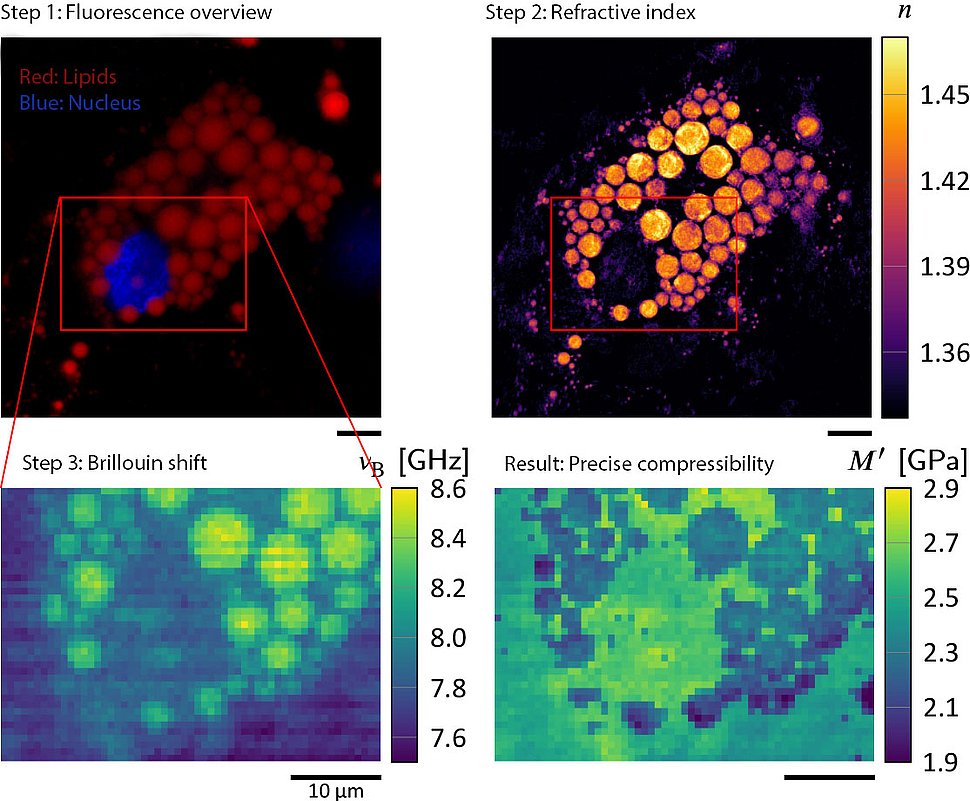
Bild: Max-Planck-Institut für die Physik des Lichts (2)
Mechanische Eigenschaften des Zellinneren und des Zellkerns wie Kompressibilität und Dichte beeinflussen deren Funktion und sind daher wichtig für das Verständnis des Zellstoffwechsels - sowohl bei gesunden als auch bei kranken Menschen. Diese Parameter helfen zu verstehen, wie sich Zellen während des Wachstums verhalten oder wie sich Krebszellen entwickeln. Eine durchschnittliche menschliche Zelle ist jedoch nur 25 Tausendstel Millimeter groß, so dass die Forscher auf mikroskopische Methoden angewiesen sind, um sie zu untersuchen.
Diese Verfahren haben in den vergangenen Jahrzehnten große Fortschritte gemacht. Mit der Brillouin-Mikroskopie beispielsweise lässt sich das Innere lebender Zellen dreidimensional und berührungslos vermessen. Vereinfacht ausgedrückt, erkennt die Methode, wie mechanische Schwingungen Lichtwellen streuen. Um mit der Brillouin-Mikroskopie beispielsweise die Kompressibilität einzelner Strukturen im Inneren der Zelle oder des noch kleineren Zellkerns genau bestimmen zu können, müssen die Forscher deren Dichte und Brechungsindex kennen, also wissen, wie Licht durch sie abgelenkt wird. Bisher gingen sie meist davon aus, dass der Brechungsindex innerhalb einer Zelle überall gleich ist und einen bekannten Wert hat. Ist dies nicht der Fall, kann es zu falschen Messergebnissen führen.
Ein Forschungsteam des Max-Planck-Instituts für die Physik des Lichts in Erlangen und des Center for Molecular and Cellular Bioengineering der Technischen Universität Dresden unter der Leitung der Physiker Raimund Schlüßler und Kyoohyun Kim in der Gruppe von Jochen Guck hat deshalb eine neue Mikroskopie-Methode entwickelt, um lokale Werte für Brechungsindex und Dichte genauer zu bestimmen. Dazu haben sie drei Methoden in einem Aufbau kombiniert: Fluoreszenzmikroskopie, optische Beugungstomographie und Brillouin-Mikroskopie - und es FOB genannt. Während erstere dazu dient, die zu untersuchenden Objekte innerhalb einer Zelle mit Hilfe von Fluoreszenzfarbstoffen zu identifizieren, bestimmt die Tomographie deren Brechungsindex. Ihre Resultate hat das Team kürzlich im renommierten Fachjournal "eLife" veröffentlicht.
Erste Messungen mit dem FOB-Aufbau liefern genauere Werte für die mechanischen Eigenschaften der Proben als dies bisher möglich war. Dabei konnten die Forscher*innen ein unerwartetes Phänomen entdecken: Das Innere des Zellkerns, das Nukleoplasma, ist weniger dicht als das umgebende Zytoplasma und sollte daher auch stärker komprimierbar sein. Überraschenderweise ist jedoch genau das Gegenteil der Fall. Sie wollen nun weiter untersuchen, wie diese ungewöhnliche Kombination zustande kommt, die sonst in speziellen Materialien in der Architektur oder in Raumfahrzeugen zu finden ist.
Außerdem können die Wissenschaftler*innen die Kompressibilität von Lipidtropfen, die in Adipozyten, auch Fettzellen genannt, gespeichert sind, genau messen. Die vorliegende Untersuchung zeigt deutlich, dass sich die Kompressibilität von Lipidtropfen nur dann präzise bestimmen lässt, wenn ihre außergewöhnlichen Brechungsindex- und Dichtewerte aus dem FOB-Aufbau berücksichtigt werden.
Mit der neuen Methode wird es in Zukunft möglich sein, zum Beispiel die Dichte und Kompressibilität des Zellkerns zu messen, wenn sich Krebszellen besonders stark vermehren. Oder wenn sich zum Beispiel im Verlauf einer Alzheimer-Erkrankung Protein-Aggregate, die Plaques, im Inneren der Zelle bilden. Solche Untersuchungen könnten eines Tages helfen, die Entstehung und den Verlauf dieser Krankheiten besser zu verstehen.
(1): Ein beweglicher Spiegel ermöglicht den Wechsel zwischen Brillouin- und ODT-Modus.
(2): Ein Blick auf die verschiedenen Bilder, die mit diesem neuen Aufbau erzeugt werden können.
Original publication.
Correlative all-optical quantification of mass density and mechanics of subcellular compartments with fluorescence specificity
Raimund Schlüßler, Kyoohyun Kim, Martin Nötzel, Anna Taubenberger, Shada Abuhattum, Timon Beck, Paul Müller, Shovamaye Maharana, Gheorghe Cojoc, Salvatore Girardo, Andreas Hermann, Simon Alberti, Jochen Guck
Kontakt
Edda Fischer
Leitung Kommunikation und Marketing
Telefon: 09131 7133 805
MPLpresse@mpl.mpg.de





