Entschlüsselung von Proteinkomplexen mit optischer Angström-Auflösung
Die kryogene optische Lokalisierung in drei Dimensionen (COLD) hat sich als praktikable Option zur Entschlüsselung von Proteinkomplexen auf Angström-Ebene erwiesen. Bisherige Arbeiten waren jedoch hinsichtlich der Anzahl der aufgelösten Fluorophore stark eingeschränkt. Ein neuer Ansatz mit der Bezeichnung "polarCOLD" hat nun die Grenzen dieser Forschung auf ein neues Niveau gehoben.
Das jüngste Aufkommen der Fluoreszenzmikroskopie mit Superauflösung (SR) hat viele clevere Innovationen hervorgebracht und neue Wege zur Untersuchung der subzellulären Organisation eröffnet und ist auf dem Weg, ein Arbeitspferd für biologische Studien zu werden. Die konventionelle SR-Mikroskopie, die bei Raumtemperatur durchgeführt wird, gilt jedoch noch immer nicht als konkurrenzfähig auf dem Gebiet der Strukturbiologie, wo Informationen auf Angström-Ebene über die molekulare Architektur einzelner Proteine und Proteinkomplexe gesucht werden.
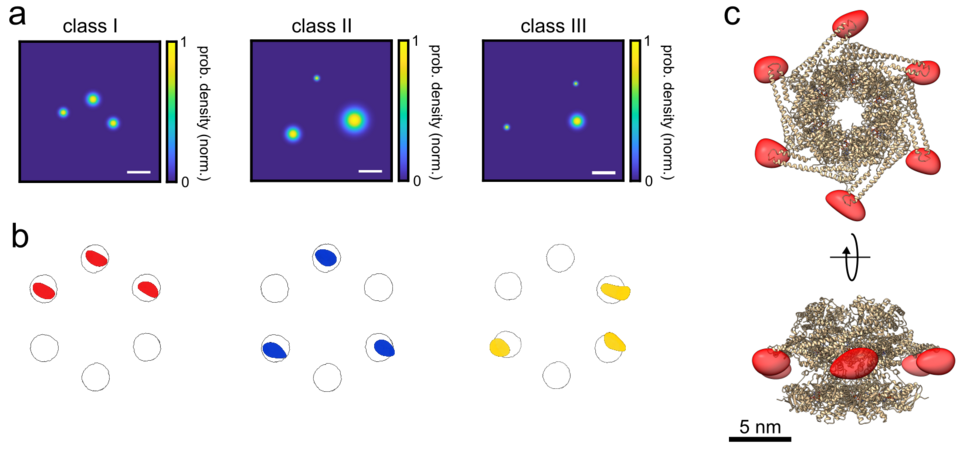
Kürzlich wurde gezeigt, dass die kryogene optische Lokalisierung in drei Dimensionen (COLD) bis zu vier Bindungsstellen auf einem einzelnen Protein mit Angström-Auflösung auflösen kann. Da frühere Arbeiten mit diesem Verfahren auf Intensitätsschwankungen beruhen, die sich aus dem Blinkverhalten von Fluorophoren ergeben, war es auf Fälle beschränkt, in denen einzelne Emitter unterschiedliche Helligkeit aufweisen, was die Anzahl der aufgelösten Fluorophore stark einschränkte. Eine neue Arbeit von Vahid Sandoghdar, Hisham Mazal und Franz-Ferdinand Wiesel vom MPL, die in der Zeitschrift eLife veröffentlicht wurde, hat nun die Grenzen dieser Forschung erweitert, indem sie die Anzahl der aufgelösten Fluorophore auf robustere Weise und mit höherer Ausbeute erweitert.
Dabei kombinierten sie die polarisationskodierte Einzelmolekül-Lokalisierung bei der Temperatur von flüssigem Helium mit partieller Markierung und 2D-Bildklassifizierungsschemata, um eine Angström-Auflösung in drei Dimensionen zu erreichen. Sie demonstrierten die Leistungsfähigkeit dieser Methode, die sie als "polarCOLD" bezeichneten, indem sie die Abstände und Anordnungen verschiedener Proteinkomplexe mit drei und sechs verschiedenen Stellen auflösten. Dieser neue Ansatz ist sehr vielversprechend für die Untersuchung der Struktur und der verschiedenen Konformationen von löslichen und Membranproteinkomplexen in schwierigen nativen Umgebungen. Darüber hinaus schließt diese Methode die Lücke zwischen Elektronen- und Lichtmikroskopie und bietet eine ideale Grundlage für die Korrelation der beiden Modalitäten auf Einzelpartikelebene.
Foto: MPL
Kontakt:
Vahid Sandoghdar
vahid.sandoghdar@mpl.mpg.de
Publikation:
Hisham Mazal, Franz Wieser and Vahid Sandoghdar, "Deciphering a hexameric protein complex with Angstrom optical resolution", https://elifesciences.org/articles/76308
Kontakt
Edda Fischer
Leitung Kommunikation und Marketing
Telefon: 09131 7133 805
MPLpresse@mpl.mpg.de





