Wann durchtrenntes Rückenmark wieder zusammenwächst
Zebrafisch Larve. Photo: Daniel Wehner
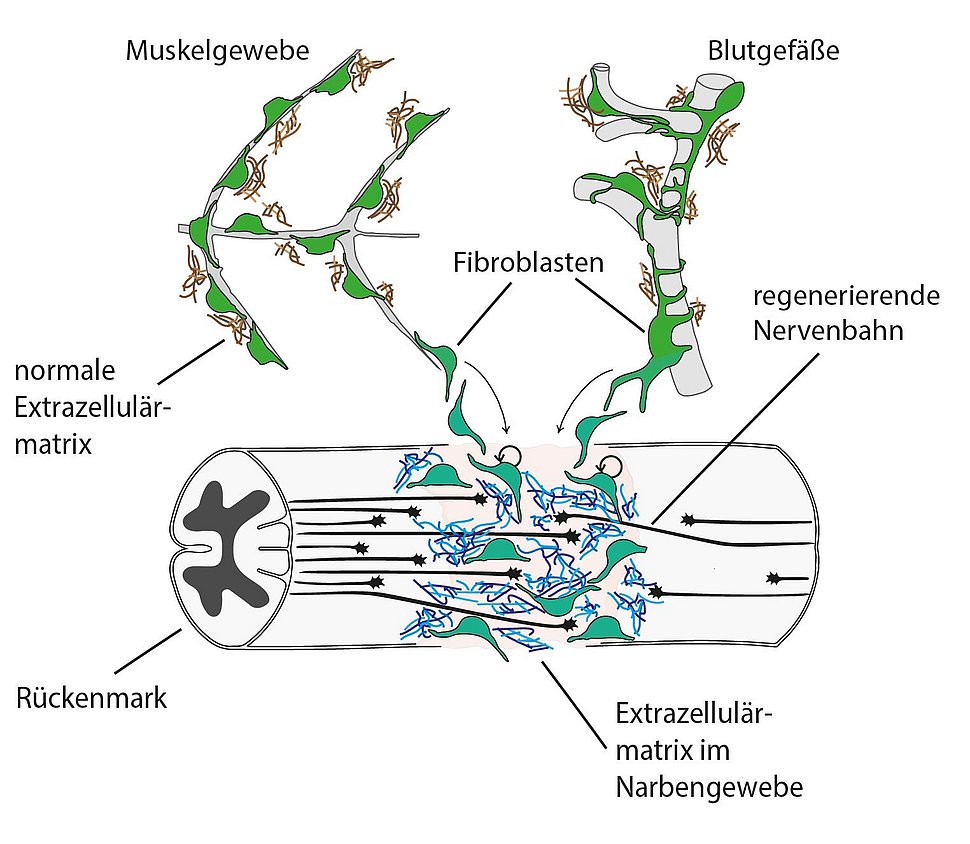
Wie Rückenmark in Zebrafischen heilt: Werden Nervenbahnen der Tiere beschädigt, wandern bestimmte Bindegewebszellen, die Fibroblasten (grün), zur Wunde und bilden Narben-artiges Wundgewebe. Dazu scheiden sie eine Extrazellulärmatrix aus (blau). Welche Zelltypen und welche hemmenden respektive stimulierenden Substanzen beim Zusammenwachsen der Nerven eine maßgebliche Rolle spielen, hat nun ein Team aus Erlanger, Dresdener und Athener Forscher*innen herausgefunden.
Nach schweren Unfällen bleiben manche Opfer gelähmt, weil verletzte Nervenbahnen aufgrund der entstehenden Narbe nicht wieder heilen. Welch wichtige Rolle dabei bestimmte Moleküle und Zellen im Narbengewebe spielen, konnten jetzt Wissenschaftler*innen vom Max-Planck-Institut für die Physik des Lichts in Erlangen gemeinsam mit Kolleg*innen aus Dresden und Athen am Beispiel von Zebrafischen zeigen.
Werden bei einem Menschen die Nervenbahnen in der Wirbelsäule beschädigt, ist der Betroffene im schlimmsten Fall ein Leben lang gelähmt und muss sogar beatmet werden. Ganz anderes als bei Zebrafischen: Wenn deren Rückenmark verletzt wird, können nachwachsende Nerven die Lücke überbrücken. Nach einiger Zeit kann der Fisch wieder schwimmen.
Der Grund für diese erstaunliche Fähigkeit: Das Narbengewebe der Zebrafische begünstigt das Wachstum von Nervenfasern, bei Säugetieren hemmt es dagegen die Regeneration. Welche Zellen, Gene und Faktoren dabei eine entscheidende Rolle im Fisch spielen, hat ein Forschungsteam rund um den Biotechnologen Daniel Wehner herausgefunden. Er leitet die Nachwuchsgruppe für Neuroregeneration in der Abteilung Biologische Optomechanik am Erlanger Max-Planck-Institut für die Physik des Lichts und am Max-Planck-Zentrum für Physik und Medizin. Ihre Ergebnisse haben die Wissenschaftler*innen jetzt im Fachmagazin Developmental Cell veröffentlicht.
Fische sind selbst nach schweren Verletzungen wieder bewegungsfähig
Sobald das Rückenmark verletzt wird, wandern in Säugetieren bestimmte Bindegewebszellen, die Fibroblasten, zur Wunde. Dort produzieren diese Zellen ein Geflecht von Molekülen, die in den Räumen zwischen den Zellen abgelagert werden und Narbengewebe bilden. Zu den Hauptbestandteilen gehören Kollagene, langgestreckte, faserförmige Proteine. Dieses Molekül-Netz, die Extrazellulärmatrix (EZM), hemmt das Wachstum von Nervenfasern – womöglich, weil die sich neu bildenden Nervenfortsätze das dichte Geflecht nicht durchdringen können, so eine verbreitete Hypothese. Daher versuchen einige Wissenschaftler*innen, die Bildung von Narbengewebe zu unterdrücken, um eine Therapie etwa für Querschnittsgelähmte zu entwickeln.
Doch das wird womöglich allein nicht genügen: Denn auch Zebrafische bilden Narben-artiges Gewebe nach Verletzung des Rückenmarks. Dennoch können die Tiere bereits nach einiger Zeit wieder schwimmen. Auch bei ihnen besiedeln Fibroblasten die Wunde und scheiden dort eine Extrazellulärmatrix aus. Wird deren Entstehung unterdrückt, wachsen die Nervenbahnen sogar schlechter zusammen, wie Wehner und seine Kolleg*innen bereits 2017 zeigen konnten.
Wie die Forscher*innen im Verlauf weiterer ausgefeilter genetischer Untersuchungen zeigen konnten, unterscheidet sich allerdings das Wundgewebe von Fischen und Säugern deutlich. Die Zusammensetzung der von Zebrafischen produzierten EZM fördert das Wachstum von Nerven sogar. Dagegen setzen ihre Bindegewebszellen, deren Herkunft die Forscher nun aufklären konnten, deutlich weniger Hemmstoffe frei, als dies bei Säugetieren der Fall ist, wo diese Substanzen die Regeneration der Nervenbahnen verlangsamen oder sogar verhindern.
Sollte es den Forscher*innen künftig gelingen, gezielt die Bildung von Hemmstoffen im Säuger zu unterdrücken und gleichzeitig die Produktion von wachstumsfördernden Substanzen anzuregen, könnte dies neue Therapiechancen für Gelähmte eröffnen. Vergleiche des Narbengewebes in Fischen und bei Nagetieren sollen dazu jetzt weitere Erkenntnisse liefern. „Doch bis unsere Ergebnisse im klinischen Alltag ankommen“, so der Max-Planck-Forscher Wehner, „werden wohl noch Jahre, wenn nicht Jahrzehnte vergehen.“
Weitere Informationen:
Dr. Daniel Wehner
Junior Research Group Neuroregeneration
daniel.wehner@mpl.mpg.de





