Mit neuer Technik können Forschende tief ins Innere von Zellen blicken – in 3-D
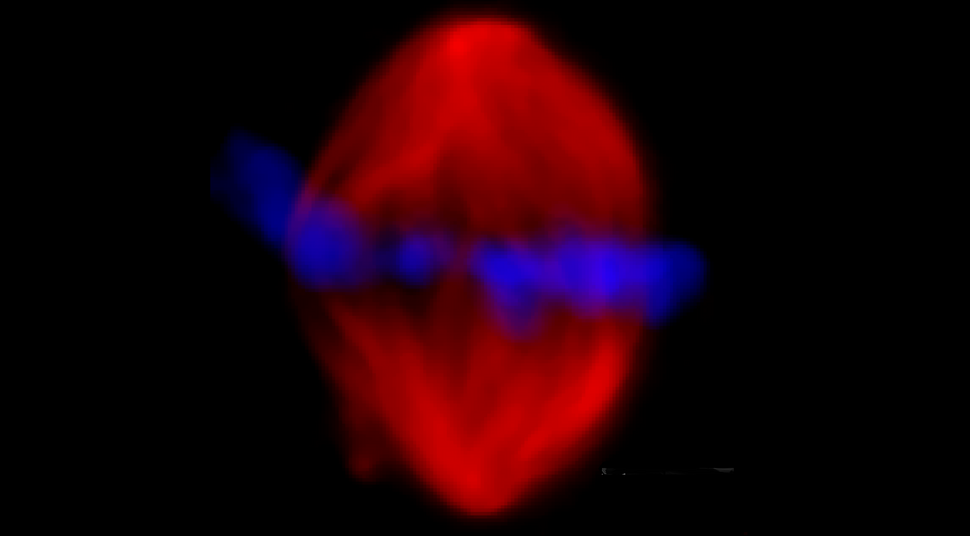
Fluoreszenzmikroskopische Aufname der mitotischen Spindel

Blick in das neue optische System. Photo: Robert Kircher-Reineke/IRI Life Sciences
Dem Geheimnis der Zellteilung auf der Spur: Wissenschaftler*innen des IRI Life Sciences der Humboldt-Universität und des Max-Planck-Instituts für die Physik des Lichts in Erlangen haben zwei mikroskopische Verfahren so kombiniert, dass sie im Detail die molekulare Maschine namens mitotische Spindel untersuchen können: Die verteilt hoch präzise die Chromosomen, wenn sich Zellen teilen.
In der Corona-Pandemie ist Abstandhalten das Gebot der Stunde – auf dem Weg zur Arbeit, beim Einkaufen oder dem Spaziergang im Park. Das Innenleben unserer Zellen bleibt davon unberührt. Dort herrscht ein dichtes Gedränge an Molekülen. Dieses Gedränge ist wichtig für die Zelle, da Interaktionen zwischen Molekülen notwendig sind, um chemische Reaktionen ablaufen zu lassen.
Die Wissenschaftler*innen des Reber Labors des IRI Life Sciences interessieren sich besonders für die Strukturen innerhalb einer Zelle, wie zum Beispiel die mitotische Spindel. Deren Funktion ist die Aufteilung der Chromosomen (unser Erbgut). Aber wie eng ist es in einer Zelle? Wie schafft es die Spindel in diesem Gedränge die Chromosomen aufzureihen? Und wie misst man das?
Kaum Durchblick im dicht gepacktem Zellinneren
Bei jeder Zellteilung muss das Erbgut, die Chromosomen, gleichmäßig auf die beiden entstehenden Tochterzellen verteilt werden. Dies erledigt eine kleine molekulare Maschine, die sogenannte mitotische Spindel. Sie sorgt für die korrekte Aufteilung der Chromosomen.
In den letzten Jahren sammelten Wissenschaftler:innen zahlreiche Erkenntnisse zu Aufbau und Funktionsweise der Spindel. Doch wichtige physikalische und mechanische Eigenschaften der Spindel sind noch immer größtenteils unbekannt. „Das hat vor allem zwei Gründe”, erklärt Prof. Dr. Simone Reber, Forschungsgruppenleiterin am IRI Life Sciences. „In komplexen Stoffgemischen wie der dicht gepackten Zelle, überlagern sich molekulare Eigenschaften der einzelnen Komponenten oder sie bilden gänzlich neue aus. Einige Eigenschaften sind auch deshalb weitgehend unverstanden, weil es bisher kaum möglich war, sie zu messen”, fügt sie hinzu.
Um nachvollziehen zu können, wie sich die Spindel bildet und welche Kräfte sie aufwenden muss, um die Chromosomen aufzureihen und auf die Tochterzellen zu verteilen, ist es wichtig, den Zusammenhang zwischen den einzelnen Bausteinen und den komplexen Materialeigenschaften zu verstehen.
Kombination aus Fluoreszenzmikroskopie und Tomographie liefert völlig neue Erkenntnisse
Vieles was die Wissenschaft über die Spindel weiß, verdankt sie der Fluoreszenzmikroskopie. Mit ihrer Hilfe lassen sich vor allem Mikrotubuli, die Spindelfasern, gut sichtbar darstellen. Aufgrund solcher Fluoreszenzbilder ging man bisher davon aus, dass die Spindel eine sehr dichte Struktur ist, in der sich Mikrotubuli, Motorproteine und andere Moleküle dicht an dicht drängen. Aber ist das tatsächlich so?
Um dieser Frage nachzugehen, bauten Dr. Abin Biswas, Postdoktorand im Labor von Simone Reber, und Dr. Kyoohyun Kim aus der Gruppe von Prof. Dr. Jochen Guck, Direktor des Max-Planck-Instituts für die Physik des Lichts in Erlangen, ein neues bildgebendes System, das die Fluoreszenzmikroskopie mit dem Verfahren der optischen Beugungstomographie (ODT = Optical diffraction tomography) verbindet. Dank dieser Kombination zweier mikroskopischer Verfahren ist es nun möglich, molekulare Informationen in 3D durch Fluoreszenz mit physikalischen Parametern, wie z. B. Dichte und Masse, mittels ODT zu verbinden.
„ODT funktioniert so ähnlich wie eine optische Mini-Waage”, sagt Dr. Abin Biswas, Erstautor der kürzlich in der Fachzeitschrift Developmental Cell veröffentlichten Studie. „Überraschend war, dass wir die Spindel im ODT überhaupt nicht sehen konnten”, ergänzt Biswas. Die Wissenschaftler:innen messen den gleichen Brechungsindex bei der Spindel und des umgebenden Zytoplasmas und schließen daraus, dass sie die gleiche Dichte aufweisen. Die Moleküle der Spindel sind also nicht dichter gepackt als die restlichen Moleküle in der Zelle. Die aktuelle Studie legt somit nahe, dass zelluläre Phasenübergänge nicht zwingend mit einem Dichteübergang verbunden sein müssen. Das bedeutet, dass sich die Spindel durch die Aufkonzentrierung benötigter Moleküle bildet – und zwar ohne Auswirkung auf die lokale Dichte.
Krebsentstehung, Erbkrankheiten: Wieso die physikalischen Eigenschaften der Spindel wichtig sind
„Wir wissen, dass fehlerhafte Spindeln die Chromosomen nicht mehr präzise verteilen können. Dies kann fatale Folgen haben”, erklärt Biswas. Zellen mit überzähligen oder fehlenden Chromosomen findet man beispielsweise in sehr vielen bösartigen Tumoren. Treten Fehler früh in der embryonalen Entwicklung auf, können daraus Trisomien, z. B. das Down-Syndrom, entstehen. Es ist daher nicht nur für die Grundlagenforschung, sondern auch für die Medizin von Interesse, die genauen Mechanismen zu verstehen, die die Materialeigenschaften der mitotischen Spindel bestimmen.
Originalpublikation
Kontact
Abin Biswas
Integrative Research Institute (IRI) for the Life Sciences
abin.biswas@iri-lifesciences.de





